食藥署訂EUA條件 肺炎疫苗第二期過關可量產
【新唐人亞太台 2020 年 10 月 27 日訊】國際疫情延燒,目前台灣已有3家廠商進行中共肺炎疫苗研發, 但到底國產疫苗什麼時候可以上市?針對臨床試驗進度,食藥署訂出緊急授權條件(EUA),只要二期臨床試驗達3000人且確認安全,將可先量產100萬劑。但之後還是得完成第三期臨床試驗後,才能取得藥證。
國內中共肺炎疫苗再傳捷報,食藥署點頭,比照美國訂出緊急授權條件,只要二期臨床試驗達3000人,追蹤一個月後確認安全有效,就可先量產100萬劑。
衛福部食藥署藥品組副組長 吳明美:「實際施打疫苗的部分,就要有三千個人以上,如果授權他EUA緊急使用上市了,他同步還要做第三期臨床試驗,等到他第三期的臨床試驗資料完整了之後呢,就不會有使用的數量跟期間的限制。」
台灣疫苗廠持續和時間賽跑,最早進入臨床試驗的國光生技,目前第一期第一劑已經打完並完成受試者收案,預估11月接種第二劑,高端、聯亞也已完成半數受試者收案,預計12月打第二劑。衛福部食藥署藥品組副組長 吳明美:「目前我們是還沒有接到任何,嚴重不良反應的一個通報,至於是不是這個疫苗有效性的情形,它在打下去之後,在血中產生中和抗體的情形,還是要等到整個試驗結束,才有辦法去知道。」
食藥署表示,如果各家試驗進度順利,最快明年5、6月就能完成第二期臨床試驗,並核准緊急授權展開量產。
新唐人亞太電視 陳輝模 詹詠茹 台灣台北報導
相關新聞
-

桃機入境下周最高峰 蘇貞昌籲過年返鄉守防疫規範
2022-01-08 21:21:52好,桃機入境人數將在14日出現最高峰,行政院長蘇貞昌不敢大意,(1/8)上午前往桃園機場視察,強調相關確診案都有軌跡可循、並在掌控中,呼籲國人在過年返鄉時,遵守防疫規範,保護自己與家人。而他也取消今晚的選前之夜出席規劃,希望能專注在防疫工作上。
-

中國「甲流」引爆心肌炎 症狀似新冠 死亡率超高
2023-03-17 21:11:04在這場當局宣稱的所謂「甲流」浪潮下,不少患者出現心肌炎症狀,民眾懷疑,這些症狀,和新冠類似,可能還是新冠病毒導致的。
-

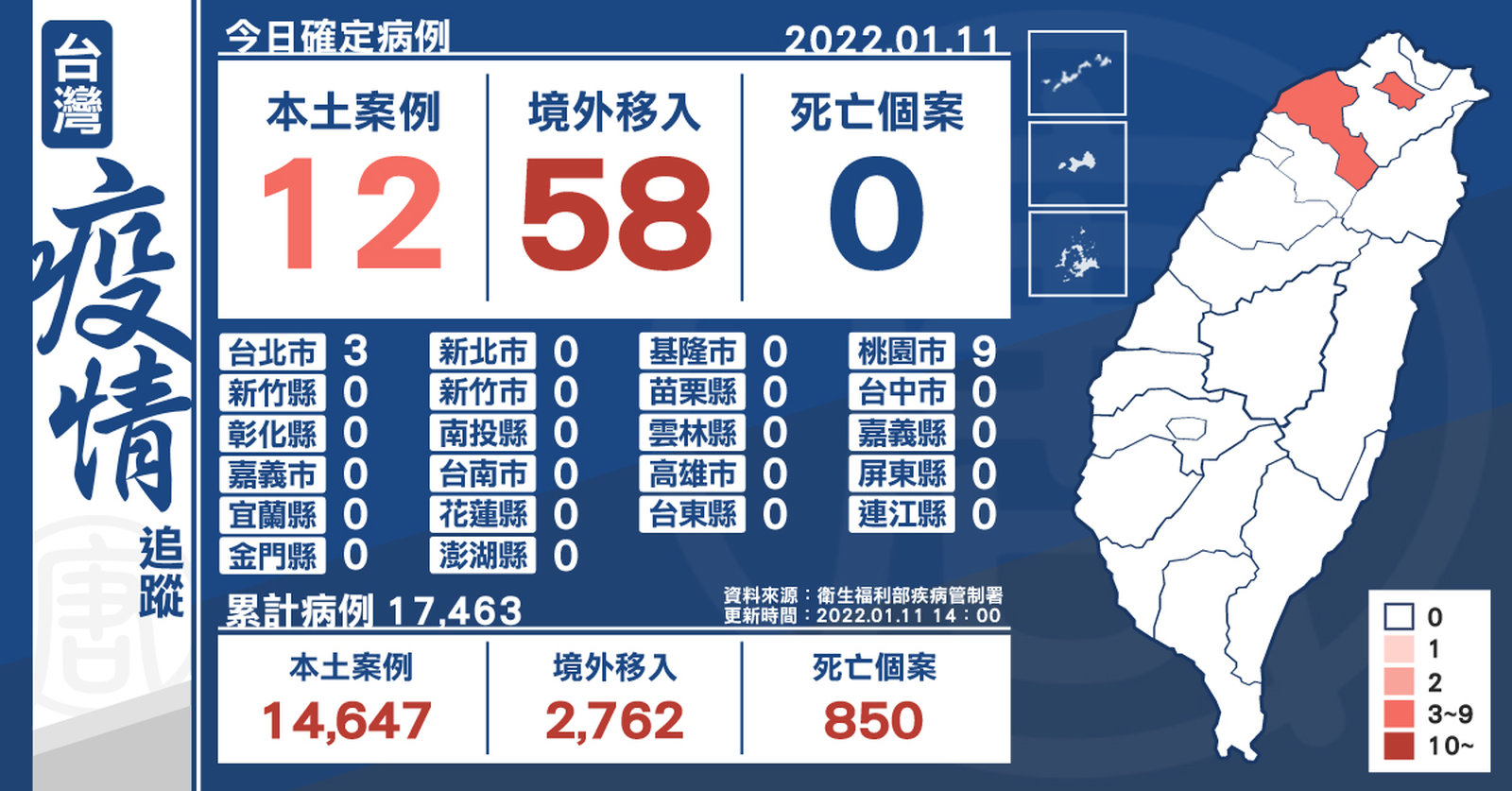
+12例本土 今早落地採陽17例 新增電子工廠群聚下午已停工
2022-01-11 16:07:49今(11)日中央流行疫情指揮中心公布,國內新增12例本土個案及58例境外移入;另確診個案中無新增死亡。
-

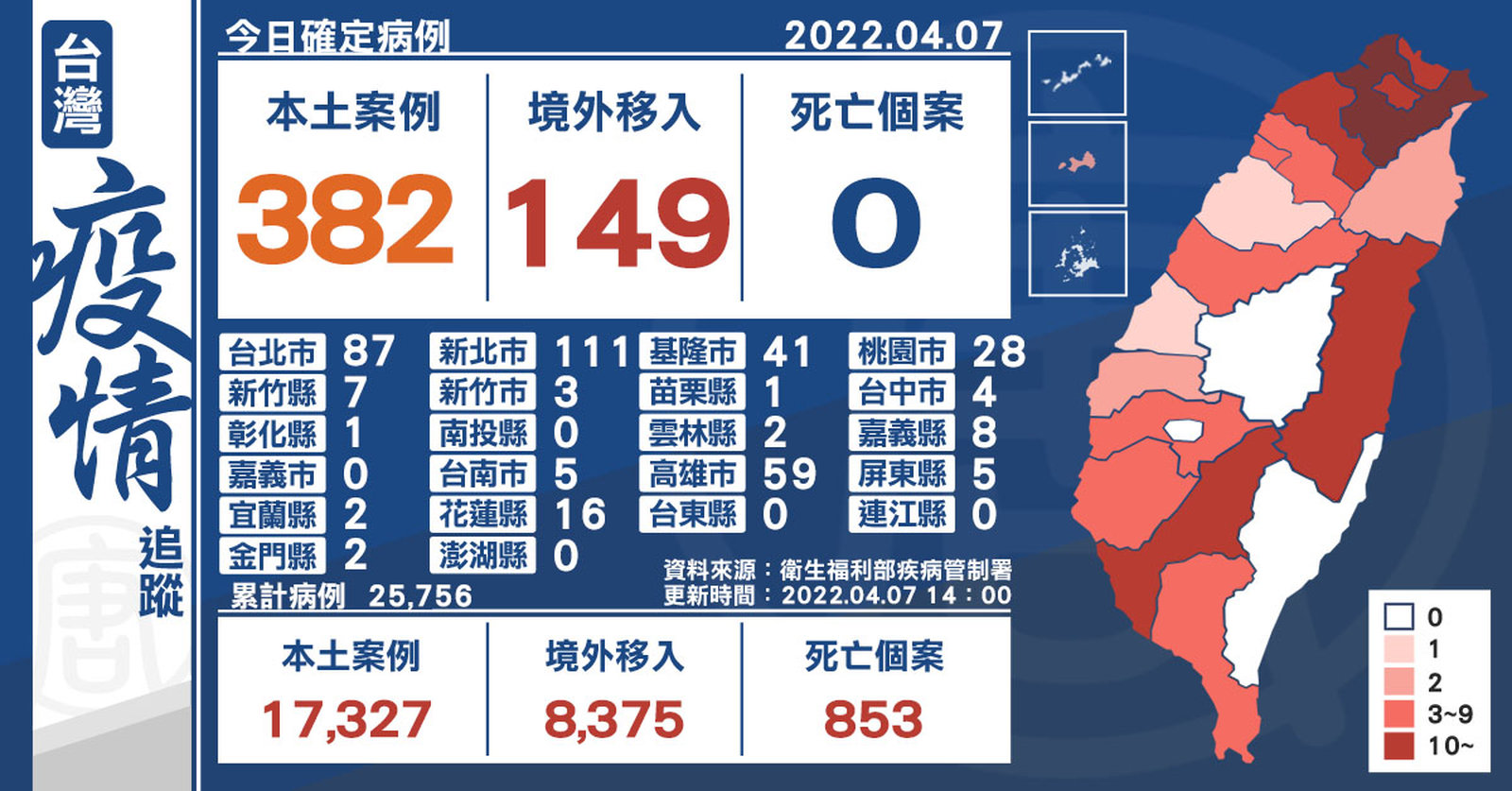
本土+382 金門2例陰轉陽 境外+149
2022-04-07 14:46:21中央流行疫情指揮中心今(7)日公布,國內新增531例COVID-19確定病例,分別為382例本土個案及149例境外移入,其中78例為航班落地採檢陽性;另確診個案無新增死亡。
-

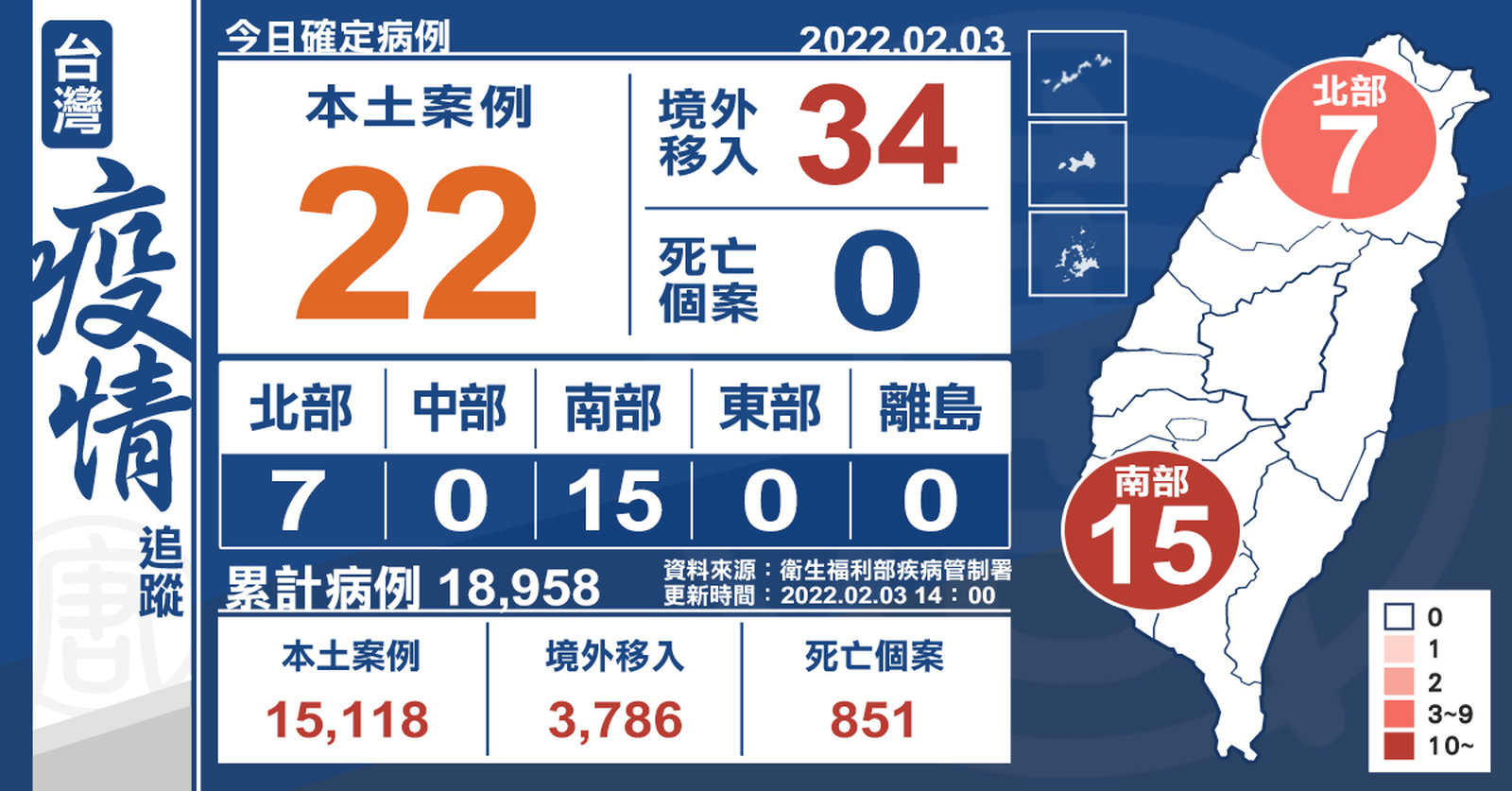
初三本土+22例!中國返台過年1家4口確診
2022-02-04 22:19:14中央流行疫情指揮中心今(3)日公布國內新增56例COVID-19確定病例,分別為22例本土個案及34例境外移入(10例為航班落地採檢陽性);另確診個案中無新增死亡。
-

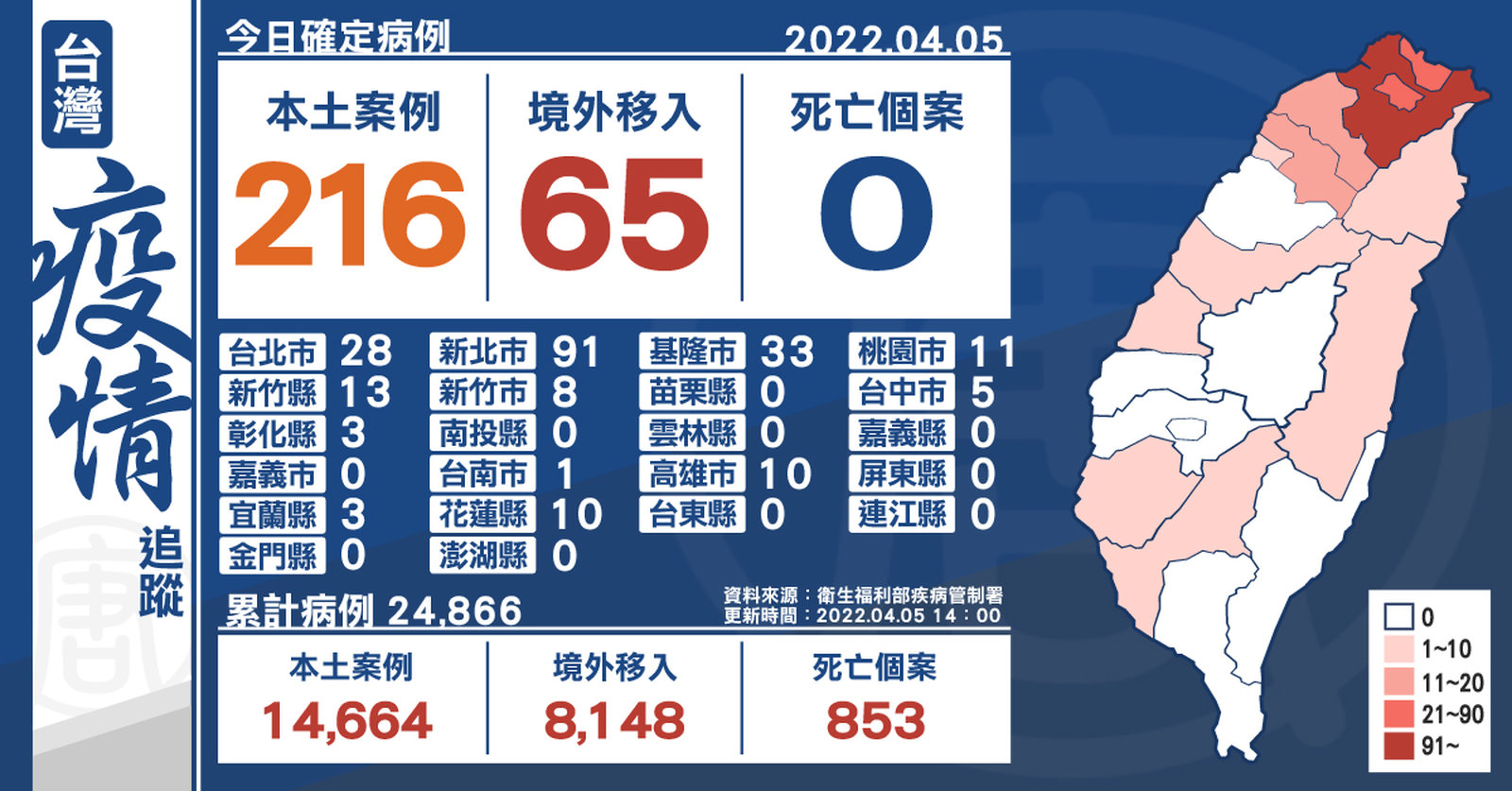
台本土+216今年首破200 新北91、基隆33
2022-04-05 14:31:22中央流行疫情指揮中心今(5)日公布,國內新增281例COVID-19確定病例,分別為216例本土個案及65例境外移入,其中28例為航班落地採檢陽性;另確診個案無新增死亡。
-

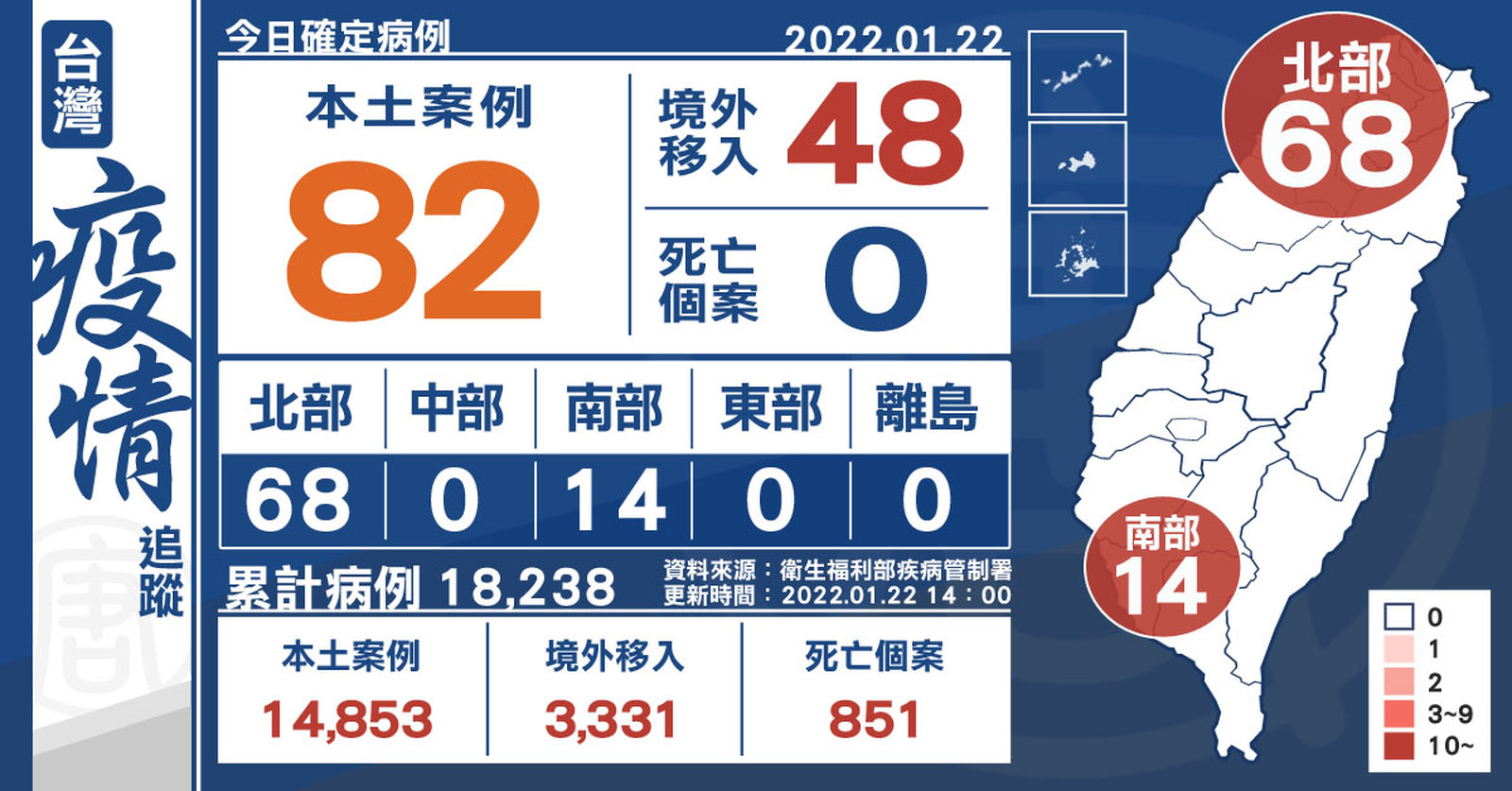
本土+82、境外+48 亞旭桃園廠群聚累計70人
2022-01-22 15:49:23今(22)日中央流行疫情指揮中心公布,國內新增130例COVID-19確定病例,分別為82例本土個案及48例境外移入;另確診個案中無新增死亡。
-

中共寧見疫情失控 拒絕美國、德國援助疫苗
2022-12-22 20:37:31中國近期疫情爆發嚴重,美國和德國政府紛紛對此表態,願意提供疫苗來協助控制疫情,然而中共寧願看人民陷於水深火熱,也不願意接受兩國的提議。
-

中共與天鬥清零失敗 陸網友轟「白肺心肌」
2023-01-03 16:38:54中共長達三年的清零封控失敗,現在疫情大爆發,出現「白肺」與「心肌炎」症狀的患者不斷蔓延至各個年齡層,有網友發文,家裡剛出生5天的新生兒,感染後遭醫院下病危通知書,右肺1/3出現白肺。由於中國本輪疫情中出現了大量「白肺」和「心肌炎」患者,中國網友更是創出了「白肺心肌」一詞,諷刺中共戰天鬥地的無效三年「清零」。目前,國際持續要求中共公布真實疫情數據,中國醫衛專家張文宏指出,過年期間,中國染疫比率可能高達80%,代表中國14億人口將有超過11億人染疫。
-

本土+15 桃園9例最多 境外移入+33 美國最多
2022-01-29 15:09:03今(29)日中央流行疫情指揮中心公布,國內新增15例本土個案及33例境外移入;另確診個案中無新增死亡。
-

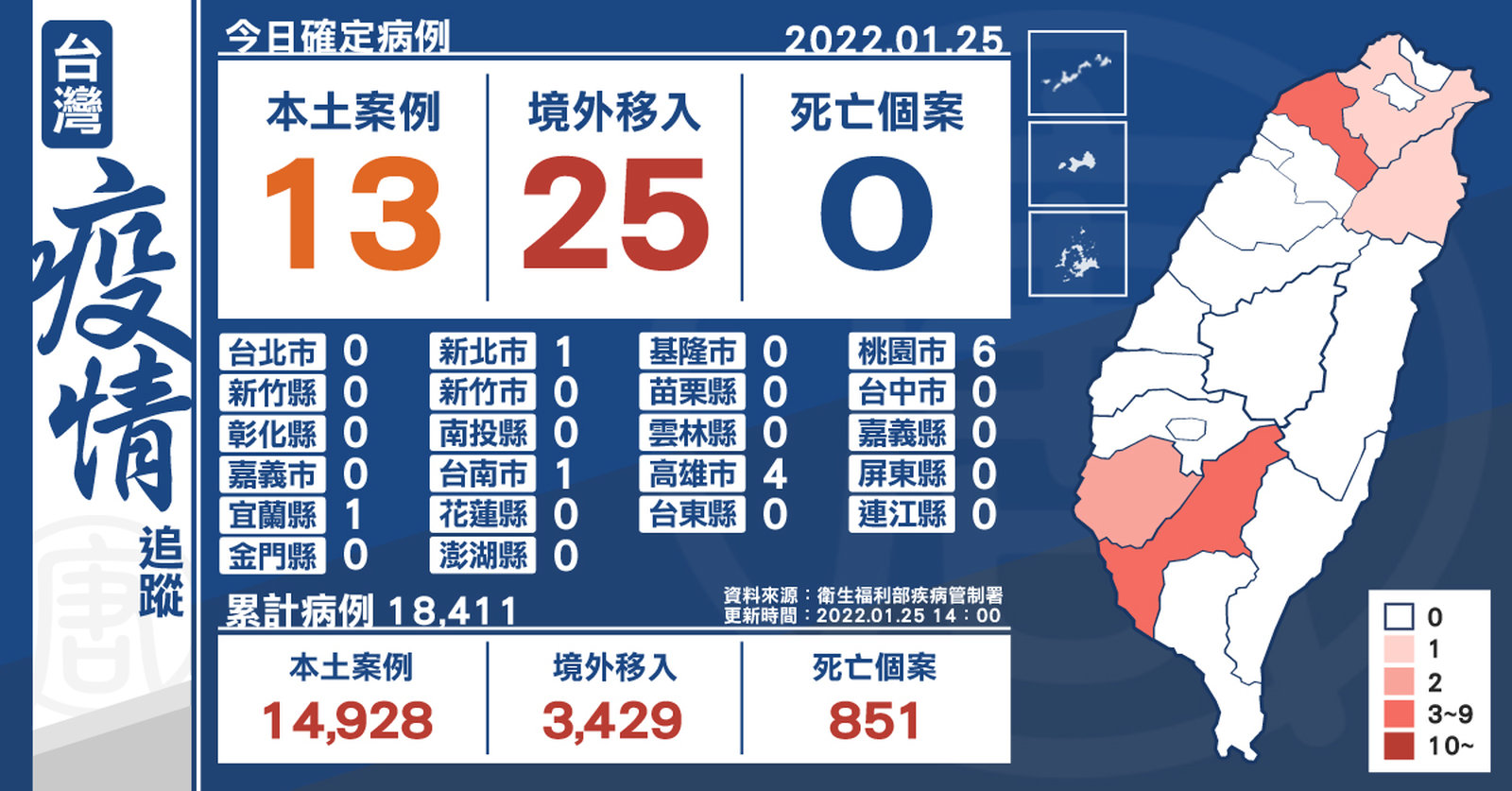
本土+13 境外移入+25 桃園增加3例不明感染源
2022-01-25 15:12:37今(1/25)中央流行疫情指揮中心宣布,新增13例本土、25例境外移入,死亡個案則未增加。新增本土個案為4例男性、9例女性,年齡介於未滿5歲至70多歲。
-

本土+15例 境外移入+36例 新年期間維持二級警戒標準
2022-01-24 15:27:42今(24)日中央流行疫情指揮中心公布,國內新增51例COVID-19確定病例,分別為15例本土個案及36例境外移入;另確診個案中無新增死亡。
-

+37例本土 11例陰轉陽 26例不明感染源 46例境外移入
2022-02-10 15:03:47今(10)日中央流行疫情指揮中心公布,國內新增83例COVID-19確定病例,分別為37例本土個案及46例境外移入,15例為航班落地採檢陽性;另確診個案中無新增死亡。
-

本土+14、死亡+1、境外51例 銀行員相關累計14人確診
2022-01-13 15:16:17今(13日)中央流行疫情指揮中心公布,新增本土14例、境外移入51例,另增1起死亡個案
-

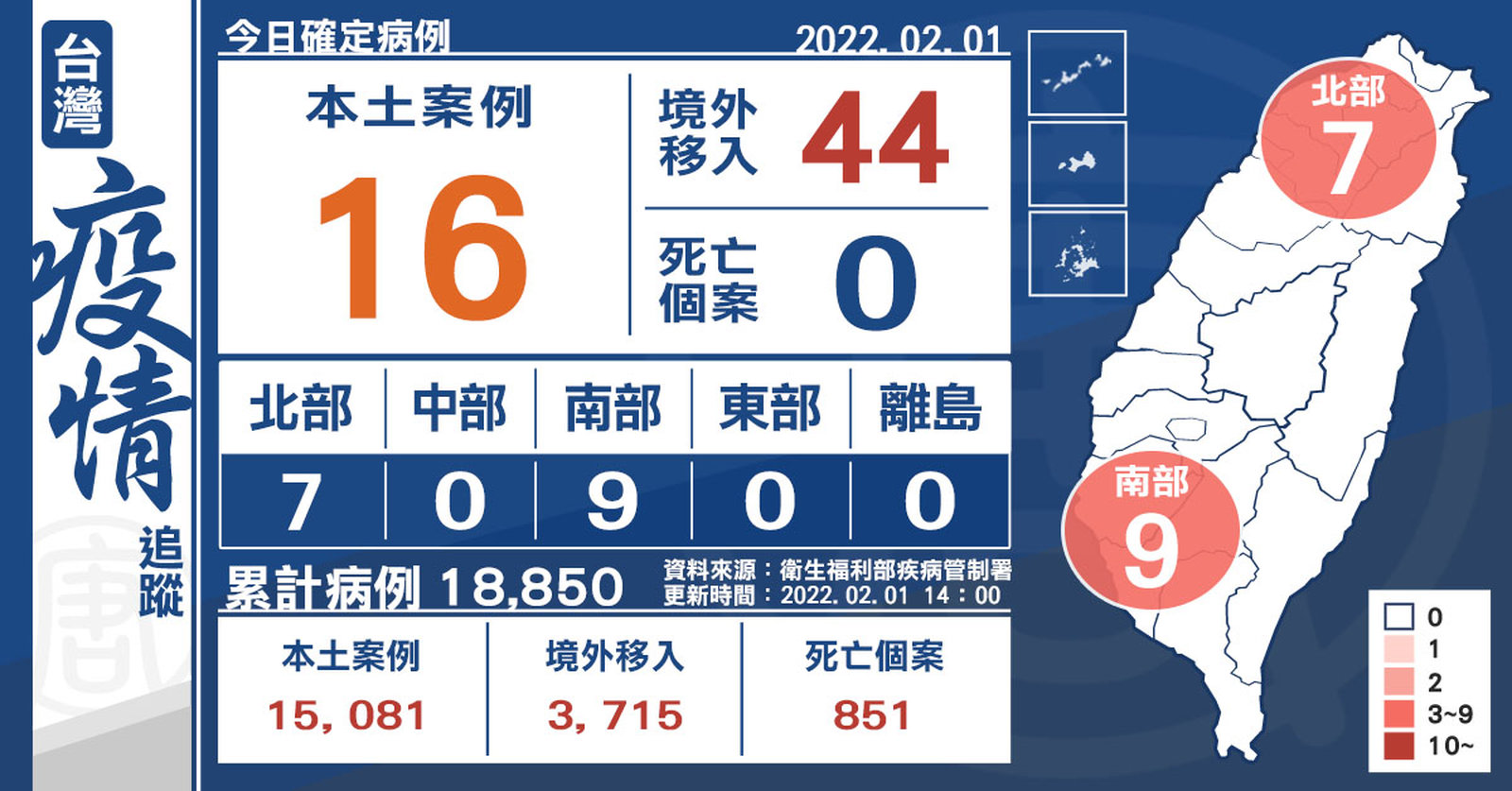
+16例本土 44例境外移入 7例落地採檢陽性
2022-02-01 15:05:48今(1)日中央流行疫情指揮中心公布,國內新增16例本土個案及44例境外移入,其中7例為航班落地採檢陽性;另確診個案中無新增死亡。
-

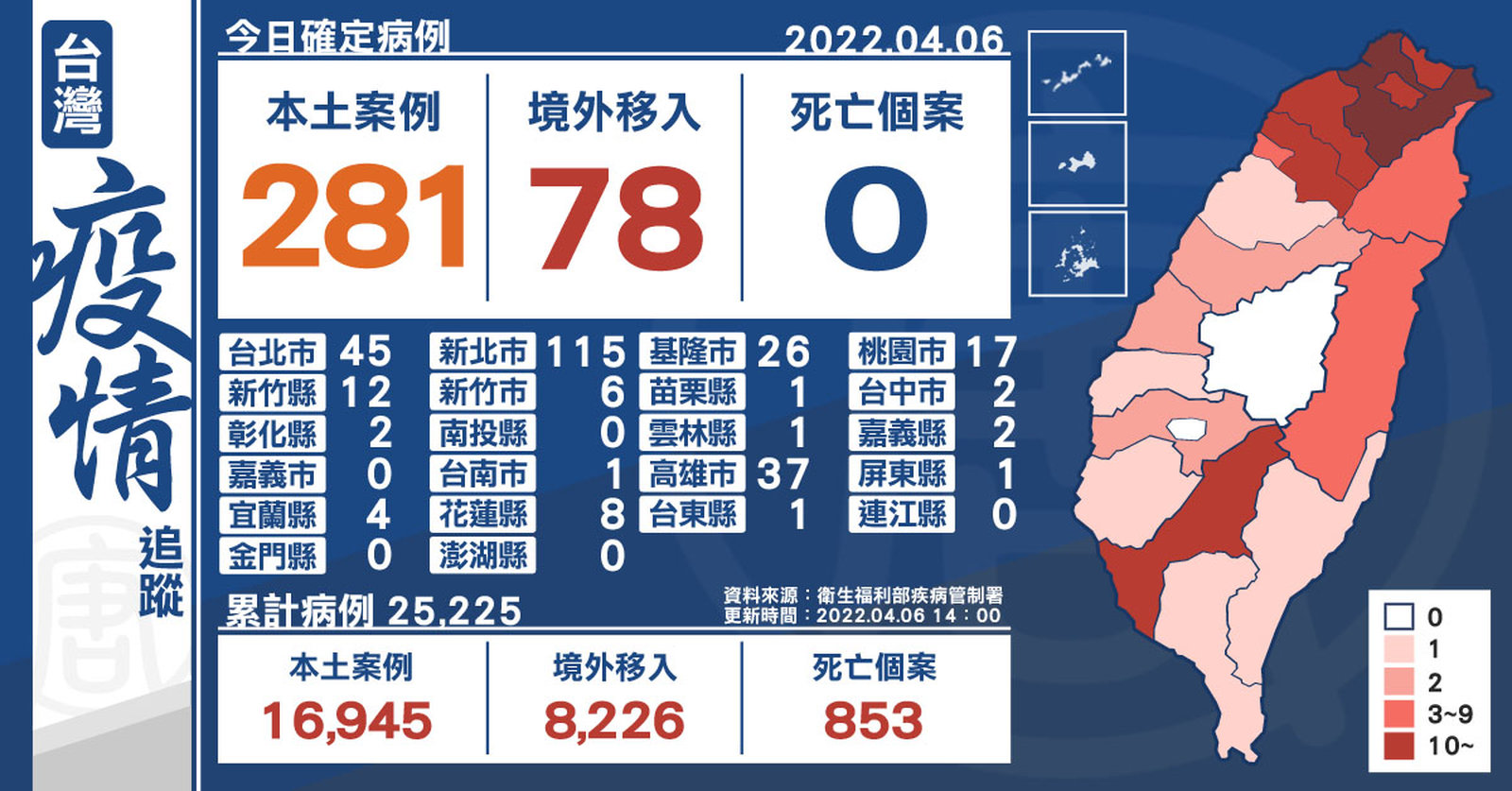
本土+281 全台17縣市確診 境外+78
2022-04-06 15:03:09中央流行疫情指揮中心今(6)日公布,國內新增359例COVID-19確定病例,分別為281例本土個案及78例境外移入,其中27例為航班落地採檢陽性;另確診個案無新增死亡。
-

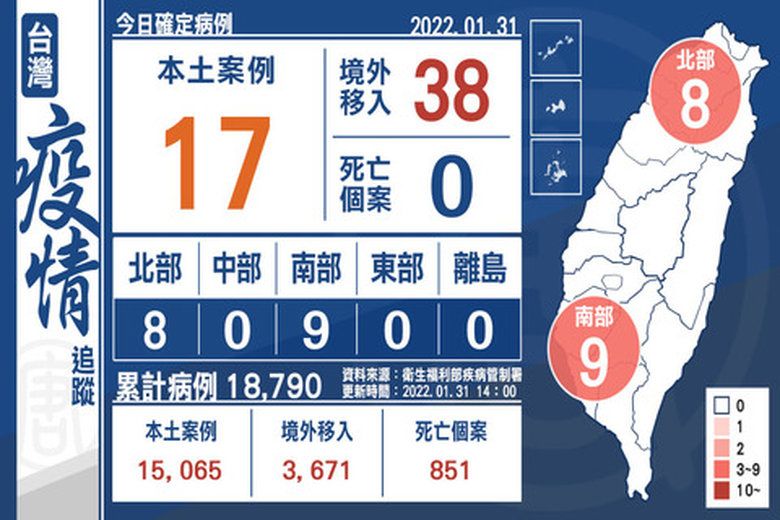
+17例本土 38例境外移入 美國最多
2022-01-31 16:33:40今(31)日中央流行疫情指揮中心公布,國內新增17例本土個案及38例境外移入(20例為航班落地採檢陽性);另確診個案中無新增死亡。
-

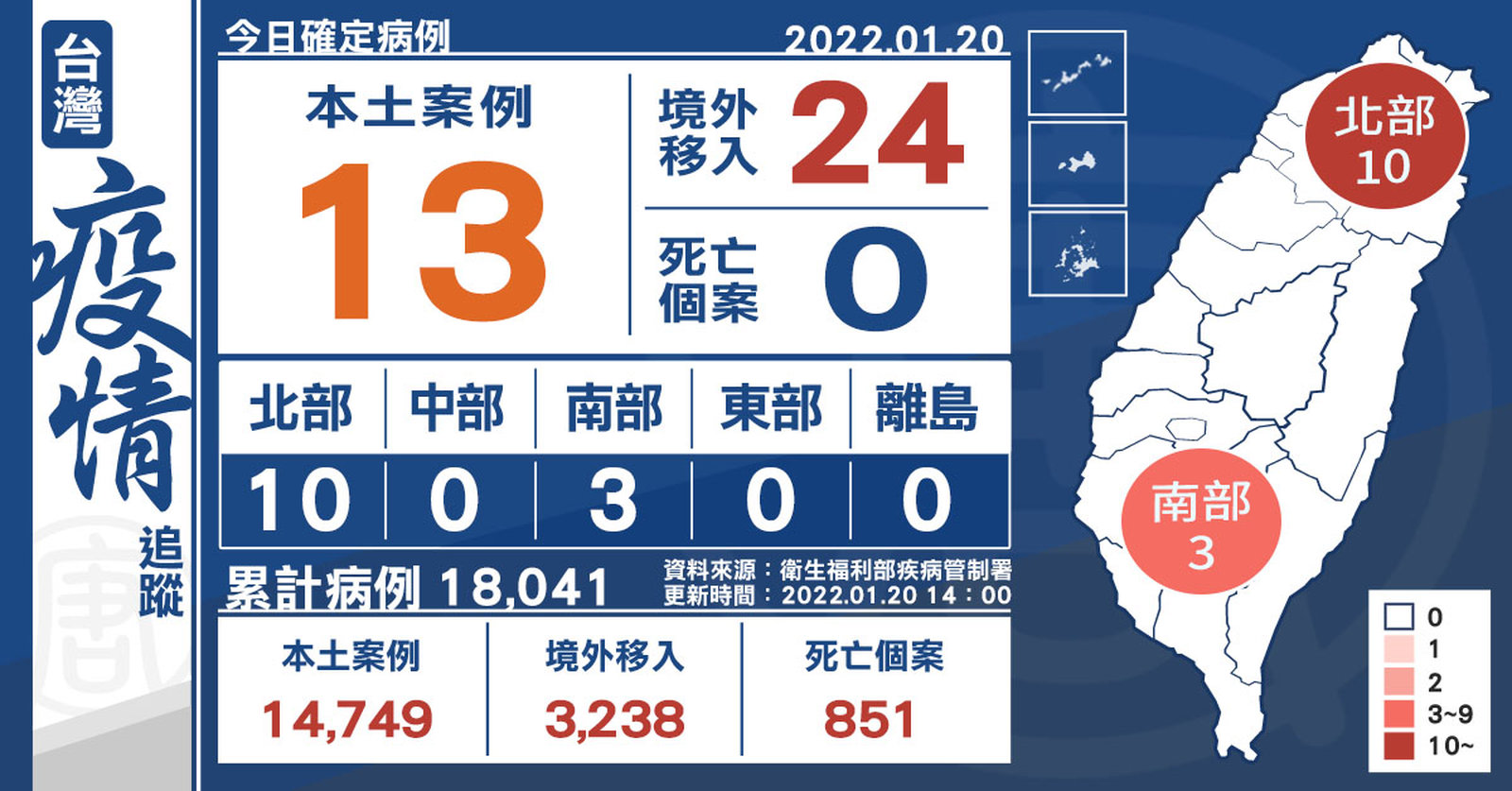
本土+13 境外+24 新確診一家三口與高雄港有關
2022-01-20 15:24:14今(20)日中央流行疫情指揮中心公布,國內新增37例COVID-19確定病例,分別為13例本土個案及24例境外移入;另確診個案中無新增死亡。
-

中國偷偷強推第4針?!拒絕者禁出門甚至收押
2023-04-04 20:20:57近日,中共御用專家鐘南山的一番話,令人擔憂,疫情再度爆發,不是空穴來風。還有民眾透露,山東正在偷偷強推第4針疫苗,如果拒絕,被禁止出門,甚至「收押」。
-

台本土+133 境外+142 雙北、桃園確診數多
2022-04-04 14:52:39中央流行疫情指揮中心今(4)日公布,國內新增275例COVID-19確定病例,分別為133例本土個案及142例境外移入,其中68例為航班落地採檢陽性;另確診個案無新增死亡。